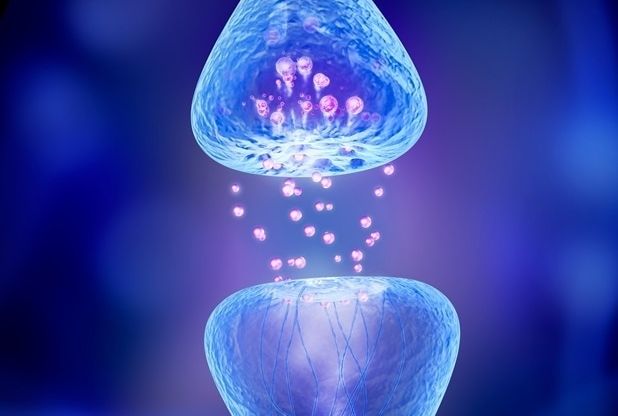
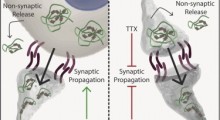
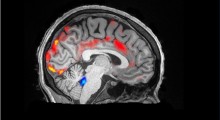
 Rappresentazione grafica di una sinapsi.
Rappresentazione grafica di una sinapsi.
Un nuovo studio sul morbo di Alzheimer (MA) eseguito da scienziati dello Scripps Research ha rivelato una cascata biochimica finora sconosciuta nel cervello, che porta alla distruzione delle sinapsi, le connessioni tra le cellule nervose responsabili della memoria e della cognizione. I risultati ci danno una nuova visuale per scoprire farmaci che trattano il MA, che riguarda circa 50 milioni di persone in tutto il mondo. Lo studio, guidato dal prof. Stuart Lipton MD/PhD, appare nella rivista Science.
Questa serie appena scoperta di eventi chimici anormali, definiti 'reazioni di transnitrosilazione proteica', contribuiscono alla perdita di sinapsi, il responsabile principale della perdita di memoria e del declino cognitivo di MA.
Lipton, che è anche neurologo clinico, spiega che i tentativi più recenti di sviluppare trattamenti di MA hanno puntato la proteina appiccicosa amiloide-beta, che si accumula nel cervello dei pazienti, interrompendo la comunicazione cellulare e causando infiammazione. Tuttavia, per una serie di motivi, questi tentativi sono falliti negli studi clinici.
"Questo lavoro ci dà nuova speranza con bersagli terapeutici migliori, poiché le reazioni che abbiamo scoperto sono a valle dell'azione dell'amiloide", afferma Lipton. "Abbiamo aperto un percorso completamente nuovo per lo sviluppo di farmaci".
Lipton non è estraneo allo sviluppo dei farmcaci di MA e di Parkinson. I farmaci sviluppati e brevettati dal suo laboratorio hanno portato a quattro medicinali approvati dalla FDA per queste malattie, compreso il farmaco più prescritto, la memantina (Namenda®). "Tuttavia, sono necessari farmaci molto migliori", dice Lipton.
Una storia di successo della chimica
Nel nuovo studio, Lipton e il suo team hanno usato tecniche di chimica fisica per quantificare in che modo gli elettroni partecipano alle reazioni chimiche, poiché sospettavano che nel cervello potessero avvenire dei processi sconosciuti. Attraverso questo, hanno scoperto la serie interamente nuova di eventi biochimici nelle cellule nervose colpite dal MA. Hanno scoperto che piccoli gruppi di proteine amiloide-beta innescano attività e infiammazione eccessive dei neuroni, portando alla serie distruttiva di reazioni di transnitrosilazione.
Il processo inizia con livelli eccessivi di atomi di azoto (N) e ossigeno (O), che si uniscono come 'gruppo NO', che viene quindi trasferito a un blocco di costruzione di proteine chiamato 'cisteina' per regolare l'attività della proteina. Una serie di queste reazioni proteiche aberranti taglia l'energia alle cellule nervose del cervello, distruggendo i loro mitocondri, gli organelli che generano energia per le reazioni biochimiche della cellula. Alla fine ciò porta alla perdita di sinapsi che collegano le cellule nervose.
"Abbiamo dimostrato che queste reazioni avvengono nel cervello dei pazienti di MA, e quando abbiamo impedito queste reazioni nel cervello di animali modello della malattia, abbiamo protetto le sinapsi", dice Lipton. "I nostri risultati suggeriscono che potrebbe essere possibile intercedere per invertire il danno sinaptico, nonostante le placche e i grovigli", ha aggiunto, riferendosi alle 'placche' di amiloide-beta e ai 'grovigli' di proteine tau mal ripiegate, entrambi caratteristici della patologia di MA.
Egli nota che, mentre i livelli normali di NO incoraggiano la memoria e l'apprendimento, mentre invecchiamo possono accumularsene livelli eccessivi, che diventano dannosi per le sinapsi.
"Con questa nuova conoscenza, potremmo riuscire a ripristinare le connessioni sinaptiche nei pazienti di MA anche dopo che nel loro cervello si sono formate ampie placche e grovigli", aggiunge Tomohiro Nakamura PhD, scienziato senior del gruppo di Lipton e primo autore dello studio.
Rivelare connessioni segrete
Lipton dice che uno dei risultati più incredibili della squadra, che i tre enzimi scoperti si passano il NO l'uno con l'altro lungo una catena concertata di eventi, con conseguente carenza energetica, finora non erano ritenuti nemmeno lontanamente legati l'uno all'altro.
Ognuno degli enzimi è importante in sé stesso in un percorso biochimico normale completamente disparato, e tuttavia interagivano in condizioni di malattia, in un modo nuovo che innesca stress neuronale intenso e danni alle sinapsi.
Lipton afferma:
"Questo tipo di percorso nascosto o 'fantasma' può essere evidente solo nelle condizioni di malattia e può rappresentare un importante principio fondamentale del motivo per cui finora non abbiamo capito il processo di malattia. Se non conosciamo un percorso, non possiamo studiare il suo contributo alla malattia o sviluppare farmaci per trattarla.
"Anche se sono stati scoperti molti percorsi biochimici molecolari, una eccessiva dipendenza da questo corpo di prove esistente può in realtà impedire la scoperta dei processi di malattia.
"Quindi, l'aspetto più importante del lavoro è che dobbiamo stare all'erta per cercare nuovi percorsi e nuove relazioni degli enzimi esistenti, per capire e trattare i disturbi neurodegenerativi come l'Alzheimer".
Fonte: Scripps Research Institute (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Tomohiro Nakamura, Chang-ki Oh, Lujian Liao, Xu Zhang, Kevin Lopez, Daniel Gibbs, Amanda Deal, Henry Scott, Brian Spencer, Eliezer Masliah, Robert Rissman, John Yates, Stuart Lipton. Noncanonical transnitrosylation network contributes to synapse loss in Alzheimer’s disease. Science, 2020, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV