Il concetto di riserva cognitiva (RC) suggerisce che l'intelligenza innata o aspetti di esperienze di vita, come le conquiste dell'istruzione o professionali, possono fornire una riserva, sotto forma di insieme di competenze o di repertori che permettono ad alcune persone di far fronte meglio di altre alla progressione della patologia di Alzheimer (AD).
Ci sono prove epidemiologiche che lo stile di vita, caratterizzato dall'impegno in attività di svago di natura intellettuale e sociale, è associato a un declino cognitivo più lento negli anziani sani e può ridurre il rischio di demenza incidente. Vi sono anche prove da studi di imaging funzionale che i soggetti impegnati in tali attività del tempo libero sono in grado di tollerare clinicamente più patologia AD. È possibile che gli aspetti delle esperienze di vita, come l'impegno in attività ricreative, possono risultare in reti cognitive funzionalmente più efficienti e quindi fornire una RC che ritarda l'insorgenza delle manifestazioni cliniche della demenza.
L'ipotesi RC suggerisce che ci sono differenze individuali nella capacità di far fronte alla patologia di AD (Stern, 2002). Ad esempio, Katzman et al. (1989) hanno descritto i casi di donne anziane cognitivamente normali, che al momento della morte hanno rivelato una patologia AD avanzata nel cervello. I ricercatori hanno ipotizzato che queste donne non avevano esibito le caratteristiche cliniche di AD, perché il loro cervello era più grande della media.
Circa il 25% dei soggetti che soddisfano nell'autopsia i criteri patologici dell'AD e sono stati valutati e seguiti in coorti ben caratterizzate clinicamente, erano intatti durante la vita (Ince, 2001). Analogamente, la maggior parte dei medici sono consapevoli del fatto che un ictus di una determinata grandezza può produrre un danno profondo in un paziente e un effetto minimo su un altro. Qualcosa deve spiegare la disgiunzione tra il grado di danno cerebrale e il suo esito, e il concetto di riserva è stato proposto proprio a questo scopo.
I dati epidemiologici che supportano l'ipotesi RC includono osservazioni che minori conseguimenti scolastici e professionali sono associati ad un maggiore rischio di demenza incidente (Stern et al., 1994). Allo stesso modo, una capacità di linguaggio inferiore nella prima infanzia (intesa come densità di idee e complessità grammaticale), e i punteggi delle caratteristiche mentali nell'infanzia, sono forti predittori di scarsa funzione cognitiva e di demenza in età avanzata (Snowdon et al., 1997; Whalley et al., 2000). Questo è coerente con la previsione che le persone con più riserva possono far fronte all'avanzare della patologia di AD più a lungo prima che si esprima clinicamente. Inoltre è stato dimostrato che i pazienti di AD con un maggiore conseguimento educativo e professionale hanno un declino cognitivo più rapido rispetto a quelli con basso raggiungimento, coerente con l'idea che, a qualsiasi livello di gravità clinica, la patologia di AD di base è più avanzata nei pazienti con più RC (Stern, Tang, Denaro, & Mayeux, 1995).
Anche fattori diversi dal QI, dall'istruzione e dall'occupazione potrebbero fornire riserva e influenzare l'incidenza dell'AD. Si è teorizzato che i cambiamenti nelle esperienze quotidiane e nei modelli di attività possono provocare disuso e conseguente atrofia dei processi e delle abilità cognitive (secondo l'adagio "usalo o lo perdi", Salthouse, 1991).
Tenuto conto della notevole plasticità delle capacità cognitive degli anziani, uno potrebbe prevedere che la pratica deliberata di tali competenze potrebbe perlomeno determinare prestazioni stabili o può addirittura invertire i cambiamenti legati all'età.
Lo stimolo fornito dalle tipiche attività quotidiane facilita mantenimento e miglioramento delle capacità cognitive generali attraverso l'esposizione alla stimolazione cognitiva (Hultsch, Hertzog, Small, & Dixon, 1999)? In altre parole, l'esperienza quotidiana può influenzare la cognizione come fa l'esercizio fisico per le funzioni musculo-scheletriche e cardiovascolari?
Molti studi hanno analizzato l'associazione tra il livello di partecipazione alle attività e le prestazioni su vari compiti cognitivi degli adulti sani (Arbuckle, Gold, & Andres, 1986; Christensen et al., 1996; Craik, Byrd, & Swanson, 1987; Erber & Szuchman, 1996; Hill, Wahlin, Winblad, & Backman, 1995; Hultsch, Hammer, & Small, 1993; Luszcz, Bryan, & Kent, 1997; van Boxtel, Langerak, Houx, & Jolles, 1996). In generale, questi studi hanno riferito che esiste una correlazione positiva tra la partecipazione alle attività intellettuali, sociali e fisiche e le prestazioni su una vasta gamma di compiti cognitivi. Tuttavia, la mancanza di profondità temporale degli studi trasversali solleva preoccupazioni circa i problemi di direzionalità causale. La partecipazione alle attività stimolanti promuove la prestazione cognitiva? O i soggetti con prestazioni cognitive migliori sono indotti a partecipare a più attività intellettuali, sociali e fisiche? I dati longitudinali possono offrire una soluzione parziale a questo enigma.
Almeno tre studi hanno usato la modellazione a equazioni strutturali nei dati longitudinali per rispondere a questa domanda. Schooler and Mulatu (2001), hanno riferito che alti livelli iniziali di funzionamento intellettivo portano ad elevati livelli di complessità ambientale, che a loro volta aumentano i livelli di funzionamento intellettuale in un periodo di 20 anni. Gold et al. (1995) hanno riferito che i soggetti con livelli più elevati di capacità intellettuale, di educazione e di status socio-economico hanno maggiori probabilità di sviluppare uno stile di vita impegnato, che a sua volta contribuisce al mantenimento di intelligenza verbale in età avanzata. Osservazioni simili sono stati riportate in un campione di 250 individui testati tre volte in 6 anni: le attività intellettualmente coinvolgenti sembravano tamponare il declino delle funzioni cognitive (Hultsch et al., 1999). Ciò nondimeno, un modello alternativo in questo studio ha suggerito che i risultati erano coerenti anche con l'ipotesi che gli individui ad alta abilità conducono una vita intellettualmente attiva fino a quando il declino cognitivo in età avanzata non limita le loro attività.
In un altro studio, sono stati gli individui con status socio-economico alto, che erano interamente impegnati nel loro ambiente, ad avere il calo intellettuale più basso su 7 e 14 anni (Schaie, 1984, 1996). In questo studio sono state le vedove che non erano mai state nel mondo del lavoro, e che esibivano uno stile di vita disimpegnato, ad mostrare il declino più grande. Infine, Arbuckle, Gold, Andres, Schwartzman, and Chaikelson (1992) hanno riferito che la partecipazione alle attività intellettuali è collegata al mantenimento delle prestazioni intellettuali in un campione di veterani della II guerra mondiale testati due volte nel corso di un periodo di 40 anni.
Sebbene i conseguimenti educativi e professionali siano stati ampiamente studiati, ci sono pochissimi rapporti ad aver esaminato l'influenza sulla demenza dello stile di vita impegnato socialmente e intellettualmente. Uno studio di controllo dei casi di AD in Giappone (Kondo, Niino, & Shido, 1994; 60 casi), ha riferito che i casi erano significativamente meno attivi in vari usi del tempo libero, hobby e comportamenti psicosociali. Un altro studio di controllo dei casi ha esaminato la presenza di attività non professionali durante la mezza età di 193 soggetti con AD possibile e probabile (Friedland et al., 2001). Quando i modelli di attività sono stati classificati in intellettuali, passivi e fisici, i casi avevano meno probabilità di aver partecipato ad attività intellettuali.
Ci sono stati solo pochi studi longitudinali prospettici che ad esaminare l'influenza sulla demenza incidente dello stile di vita socialmente e intellettualmente impegnato. E' stata studiata in un campione di indagine di 422 soggetti anziani la relazione tra diversi indicatori di status socio-economico e la demenza incidente (Bickel & Cooper, 1994). Solo alloggi di qualità scadente sono stati associati ad un maggiore rischio di demenza incidente, mentre gli indicatori di isolamento sociale (come bassa frequenza di contatti sociali all'interno e all'esterno della cerchia familiare, basso tenore di supporto sociale, e vivere da soli in una casa) hanno dimostrato di non essere significativi.
In un'altra coorte, è stato valutato in 1.877 soggetti il numero medio di minuti al giorno di partecipazione ad attività cognitivamente difficili, "complesse" (es.: suonare uno strumento musicale, artigianato) e "semplici" di base come vestirsi o mangiare (Zabar, Corrada, Fozard, Costa, & Kawas, 1996). La partecipazione regolare a attività complesse (rispetto a quelle semplici) ha ridotto il rischio di sviluppare demenza entro 2 anni, ma non entro i 5, 10 o 15 anni, il che suggerisce che l'effetto vicino al momento della diagnosi può riflettere i cambiamenti nelle attività a causa di demenza precoce. Purtroppo, questo studio è stato pubblicato solo in una forma astratta e non sono stati dati dettagli.
Un altro studio ha valutato i dati delle attività sociali e ricreative di 2.040 anziani senza demenza residenti nella Gironda (Francia) e ha registrato la demenza incidente nelle visite di follow-up (Fabrigoule et al., 1995). Viaggiare, fare lavoretti e lavorare a maglia sono stati associati ad un minor rischio di demenza incidente quando è stato controllato lo stato occupazionale. Tuttavia, le analisi non sono state controllate per etnia, genere, livello di istruzione, fattori di rischio cerebrovascolari o sintomatologia depressiva. Inoltre, per il lavoro occasionale e quello a maglia, l'effetto è stato significativo solo quando i soggetti che hanno fatto le attività senza difficoltà sono stati confrontati con soggetti che non le hanno fatte a causa di carenze o disabilità. Quando il gruppo di controllo era composto da soggetti che non erano impegnati in queste due attività per altri motivi, non è stata osservata alcuna influenza significativa. Pertanto la demenza in questo studio sembrava essere interessata dalle ragioni per impegnarsi in attività del tempo libero, piuttosto che dalle attività in sé stesse.
Ci sono stati almeno tre grandi studi prospettici che hanno dimostrato una chiara associazione tra lo stile di vita impegnato e la demenza incidente. In uno di essi, sono stati valutati i legami sociali (coniuge, modalità di vita, contatti con amici e parenti, reciprocità confidente e appartenenza a un gruppo) e la partecipazione alle attività produttive (aiutare gli altri nelle attività quotidiane, lavoro retribuito e lavoro volontario), per 2.486 ospiti di comunità di uomini nippo-americani (senza demenza all'inizio dello studio), che sono stati seguiti per 3 anni (Balfour, Masaki, White, & Launer, 2001). Sia le attività di coinvolgimento sociale che quelle produttive erano significativamente e inversamente associate al rischio di demenza incidente. Per ogni ulteriore legame sociale, l'OR della demenza diminuiva del 16% e per ogni attività produttiva aggiuntiva, l'OR della demenza diminuiva del 72% e l'effetto delle due scale era sinergico. Questo studio è disponibile solo in forma astratta.
Recentemente abbiamo riferito i risultati di uno studio che ha coinvolto in totale 1.772 individui senza demenza over-65, che vivono nel Nord Manhattan a New York, identificati e seguiti longitudinalmente fino a 7 anni (media 2,9 anni) da uno studio di incidenza di coorte basato su comunità (Scarmeas, Levy, Tang, Manly, & Stern, 2001). Nella visita iniziale, una intervista ha fatto emergere le partecipazioni auto-riferite a una serie di attività del tempo libero di natura intellettuale (lettura di riviste o giornali o libri, carte o giochi o bingo, seguire corsi, ecc.), sociale (visitare o essere visitati da amici o parenti, ecc.) e anche fisica (camminare per piacere o per escursioni, condizionamento fisico, ecc.).
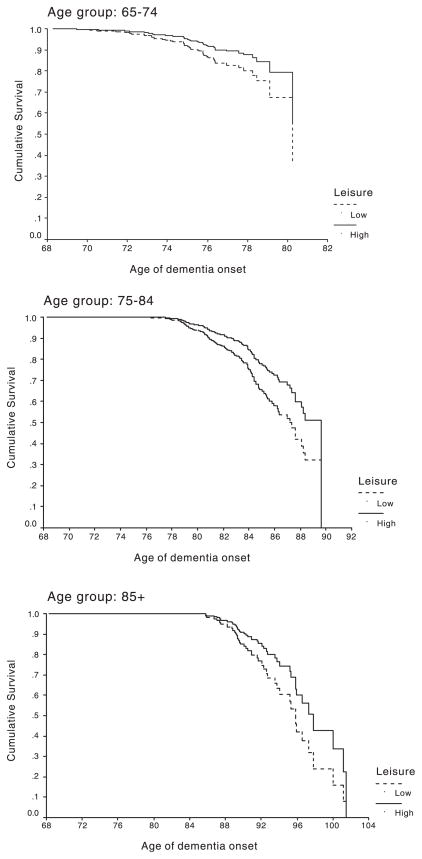 Figura 1 - Curva di sopravvivenza in base all'analisi di Cox che confronta l'incidenza cumulativa della demenza in soggetti con attività alta e bassa del tempo libero in tre gruppi di età della coorte (Fonte: Scarmeas et al., 2001).La Figura 1 presenta il rischio cumulativo di sviluppare la demenza nei gruppi di attività alta e bassa del tempo libero, come calcolato dai modelli di analisi di sopravvivenza. Anche dopo aver controllato i fattori come il gruppo etnico, l'istruzione e l'occupazione, i soggetti con elevata attività del tempo libero avevano il 38% in meno di rischio di sviluppare demenza. Il rischio di demenza incidente si è ridotto di circa il 12% per ogni attività aggiuntiva adottata nel tempo libero. L'effetto delle attività ricreative sulla demenza incidente restava presente anche considerando le prestazioni cognitive di base, le limitazioni sanitarie che interferiscono con le attività sociali, le malattie cerebrovascolari e la depressione.
Figura 1 - Curva di sopravvivenza in base all'analisi di Cox che confronta l'incidenza cumulativa della demenza in soggetti con attività alta e bassa del tempo libero in tre gruppi di età della coorte (Fonte: Scarmeas et al., 2001).La Figura 1 presenta il rischio cumulativo di sviluppare la demenza nei gruppi di attività alta e bassa del tempo libero, come calcolato dai modelli di analisi di sopravvivenza. Anche dopo aver controllato i fattori come il gruppo etnico, l'istruzione e l'occupazione, i soggetti con elevata attività del tempo libero avevano il 38% in meno di rischio di sviluppare demenza. Il rischio di demenza incidente si è ridotto di circa il 12% per ogni attività aggiuntiva adottata nel tempo libero. L'effetto delle attività ricreative sulla demenza incidente restava presente anche considerando le prestazioni cognitive di base, le limitazioni sanitarie che interferiscono con le attività sociali, le malattie cerebrovascolari e la depressione.
In un altro studio prospettico, la frequenza di partecipazione alle attività cognitive comuni (ad esempio, la lettura di giornali, riviste, libri) è stata valutata al basale per 801 suore, sacerdoti e frati cattolici anziani, senza demenza (Wilson et al., 2002). Durante un periodo medio di studio di 4,5 anni, l'aumento di 1 punto nel punteggio dell'attività cognitiva è stato associato a una riduzione del 33% del rischio di AD. Inoltre, l'impegno in attività cognitive è stato associato anche a tassi più lenti di declino cognitivo. I risultati restano anche dopo aver controllato molti potenziali fattori confondenti e anche quando sono stati esclusi dalle analisi i soggetti con compromissione della memoria al basale.
Contrariamente agli studi precedenti che avevano indagato sul rischio di demenza incidente, un altro studio dello stesso gruppo ha esplorato il tasso di declino cognitivo in relazione alle attività di lettura premorbose in soggetti che avevano già manifestato la malattia. In una coorte di 410 persone con AD, seguiti per 4 anni, livelli più elevati di attività premorbosa di lettura erano associati a un declino più rapido nelle misure cognitive e verbali globali (Wilson et al., 2000). Anche se controintuitivi a prima vista, i risultati sono coerenti con l'ipotesi che le attività intellettuali possono aumentare la capacità di riserva del cervello e che a qualsiasi livello di gravità clinica, la patologia di base dell'AD è più avanzata in pazienti con più RC. Pertanto, anche se i soggetti con maggiore RC (rispetto a quelli con minore RC) possono manifestare la sintomatologia di demenza più avanti nella vita, possono declinare più velocemente dopo l'esordio della demenza. Questi risultati dell'attività di lettura corrispondono a risultati simili precedenti per l'istruzione e l'occupazione (Stern, Tang et al., 1995).
I dati fisiologici derivanti da studi di scansioni funzionali sono serviti come conferma indiretta dell'ipotesi della riserva. Dato che è ben consolidata la correlazione regionale tra deficit del flusso ematico cerebrale (CBF) PET e modifiche istologicamente confermate postmortem della demenza, il CBF è stato usato come misura indiretta/surrogato della patologia di malattia (CBF inferiore indica una patologia più avanzata). E' stato dimostrato che i pazienti con maggiore conseguimento educativo (Stern, Alexander, Prohovnik, & Mayeux, 1992), o professionale (Stern, Alexander et al., 1995), così come quelli con QI premorboso più alto (Alexander et al., 1997) hanno deficit più importanti di flusso (e quindi più patologia) quando si controlla la gravità clinica. Queste osservazioni supportano la predizione che gli individui con più di riserva possono tollerare più patologia.
I risultati di uno studio recente che invoca le attività del tempo libero sembrano paralleli a quelli per l'istruzione, l'occupazione e il QI. Abbiamo valutato le attività del tempo libero (intellettuale, sociale e fisico) in 9 pazienti con AD precoce e 16 anziani sani, sottoponendoli a PET H215O cerebrale (Scarmeas et al., in corso di stampa). In un'analisi di regressione multipla tipo-voxel che controllava la gravità clinica, c'era una correlazione negativa tra il punteggio delle attività del tempo libero e il CBF. Quando sono stati aggiunti l'educazione o le stime di QI premorboso, o entrambi, come covariate nello stesso modello, i punteggi più alti di attività ricreative sono rimasti associati a deficit più prominenti del CBF. Questi risultati confermano l'ipotesi che in un dato livello di gravità clinica della malattia, esiste una patologia di AD più grave nei pazienti con molta attività del tempo libero, anche quando istruzione e QI sono presi in considerazione.
Anche se ha intuitivamente senso che solo le attività cognitivamente stimolanti possano essere correlate al rischio di demenza, c'è la prova che anche le attività non cognitive sono protettive. Nel nostro studio, quando le attività del tempo libero sono state raggruppate in fattori fisici, sociali e intellettuali, anche se il fattore intellettuale è stato associato a un rischio più basso di demenza incidente, tutti e tre i fattori hanno mantenuto il loro effetto significativo nelle analisi (Scarmeas et al., 2001).
L'evidenza epidemiologica che l'esercizio fisico può ritardare il deterioramento cognitivo è equivoca. Mentre alti livelli di attività fisica sono stati associati a ridotto rischio di demenza in almeno quattro studi prospettici (Laurin, Verreault, Lindsay, MacPherson, & Rockwood, 2001; Li et al., 1991; Scarmeas et al., 2001; Yoshitake et al., 1995), nessun effetto dell'esercizio fisico sul rischio di demenza e deterioramento cognitivo è stato segnalato da altre coorti (Broe et al., 1998; Wilson et al., 2002). Inoltre, c'è la prova dalla ricerca di base che l'arricchimento ambientale, sotto forma di corsa volontaria sulla ruota, è associato ad una maggiore neurogenesi nel giro dentato del topo adulto (van Praag, Kempermann, & Gage, 1999). È stato anche dimostrato che l'attività fisica sostiene il flusso sanguigno cerebrale (Rogers, Meyer, & Mortel, 1990) e può migliorare la capacità aerobica e la fornitura di nutrienti al cervello (Dustman et al., 1984; Spirduso, 1980). Pertanto, anche se è concepibile che l'attività fisica possa essere semplicemente un marcatore non specifico di buona salute, collegato indirettamente alla demenza (o anche non legato affatto alla demenza), è possibile anche che abbia una associazione fisiologica diretta con la malattia del cervello.
L'associazione tra lo stile di vita impegnato e il rischio di demenza potrebbe essere mediato oppure confuso dalle abilità come il QI o l'istruzione. Se questo è il caso allora potrebbe essere che il QI oppure l'istruzione rappresentino i nessi causali veri con la demenza o che i soggetti con QI o istruzione maggiori tendano ad adottare uno stile di vita che da sè stesso riduce causalmente il rischio di demenza (come l'esercizio fisico, la dieta, ecc.). Tuttavia, negli studi in cui sono stati controllati l'istruzione e l'occupazione (Scarmeas et al., 2001), o l'istruzione e il QI (Scarmeas et al., in corso di stampa), l'associazione tra attività di svago e rischio di demenza era ancora presente.
E' anche possibile che sia istruzione-occupazione-QI, sia l'impegno in attività professionali stimolanti, siano indicatori di capacità innate. Innato potrebbe riferirsi a un ambiente genetico o a fattori di sviluppo giovanili o a una loro combinazione. Queste capacità innate potrebbero a loro volta portare a livelli più elevati di istruzione, maggiore impegno in attività professionali stimolanti e un minor rischio di declino cognitivo.
Può anche essere che ci sia un altro fattore causale-caratteristica ancora non identificata che confonde o media l'associazione inversa tra lo stile di vita impegnato e la demenza incidente.
Un'altra spiegazione dei risultati potrebbe essere che i soggetti incerti affetti da demenza potrebbero avere minori attività di svago a causa di malattia precoce. La conseguenza di una tale premessa sarebbe che una bassa attività di svago, come registrato negli studi epidemiologici, rappresenta una manifestazione di demenza precoce piuttosto che un fattore di rischio premorboso in sé. Alcuni studi hanno tentato di risolvere parzialmente questo dubbio escludendo dalle analisi i soggetti con deterioramento della memoria al basale o prendendo in considerazione le prestazioni cognitive basali nelle analisi (Scarmeas et al., 2001; Wilson et al., 2002). Anche se in questi studi è rimasto invariato l'effetto protettivo delle attività del tempo libero, le attività sono state registrate solo pochi anni prima dell'incidenza della demenza. Più è lungo l'intervallo tra la valutazione di tali attività e la diagnosi di demenza, più ci si può fidare della temporalità e della causalità del rapporto. Nel complesso, data la letteratura attuale, non può essere completamente escluso lo scenario di uno stile di vita colpito da una sottile malattia cerebrale incipiente.
Le attività del tempo libero possono mediare la protezione attraverso molti modi diversi, varie versioni della ipotesi RC.
- Passiva o hardware: Un cervello più grande tollera di più perdite, prima di esibire la funzione compromessa, per merito del maggior numero di sinapsi o neuroni sani, con conseguente aumento del numero di quelli che restano disponibili quando una certa percentuale di loro è interessata da un processo patologico (Katzman et al., 1988). Uno stile di vita impegnato intellettualmente e socialmente può aumentare la densità sinaptica nella corteccia neocorticale di associazione (sulla base della stimolazione - Katzman, 1993), inducendo una funzione cognitiva più efficiente dei neuroni non danneggiati, che potrebbe compensare la perdita di funzione delle aree cerebrali colpite.
- Attiva o software: Uso più efficiente delle stesse reti del cervello. Anche se il numero di neuroni o sinapsi dovesse essere lo stesso, potrebbe esistere una maggiore attività sinaptica, o dei circuiti più efficienti della connettività sinaptica, nei soggetti che fanno più attività nel tempo libero.
- Attiva o software: Uso più efficiente delle reti alternative del cervello, cioè capacità più efficace di spostare le operazioni verso circuiti alternativi. Come esempio concreto, un matematico allenato o qualcuno impegnato da tutta la vita nella formazione matematica, potrebbe essere in grado di risolvere un problema di matematica in molti modi diversi, mentre un individuo meno esperto può avere disponibile una sola strategia possibile di soluzione. Il matematico ha una maggiore flessibilità nel risolvere il problema, se una particolare strategia di soluzione è preclusa. Questa ridondanza integrata permetterà una maggiore resilienza di fronte ai danni cerebrali.
Infine, è plausibile che i fattori che influenzano la RC possano anche diventare ostacoli di per sé allo sviluppo della patologia di malattia. Anche il coinvolgimento in occupazioni impegnative durante la vita può diminuire la neurodegenerazione. Questo potrebbe essere mediato da una serie di processi neurobiologici sottostanti come una maggiore attivazione cronica neuronale associata ad un aumento di lavoro del cervello, aumento del flusso ematico regionale cerebrale, e un maggiore metabolismo del glucosio e dell'ossigeno (Friedland, 1993) o anche tramite la maggiore capacità di generare nuovi neuroni in età adulta (Eriksson et al., 1998; Johansson, Svensson, Wallstedt, Janson, & Frisen, 1999; Kukekov et al., 1999), che potrebbe contribuire a compensare le perdite cellulari con guadagni cellulari.
L'ipotesi che le modifiche allo stile di vita influenzino l'esito della malattia cerebrale diventa ancora più interessante di fronte alla crescente letteratura di ricerche animali sulla plasticità neuronale e la sua associazione con l'apprendimento, e l'ambiente fisicamente e socialmente arricchito.
L'esposizione a un ambiente più ricco, definita come una combinazione di maggiori opportunità di attività fisica, apprendimento e interazione sociale, non solo produce una serie di cambiamenti strutturali e funzionali del cervello, ma influenza anche il tasso di neurogenesi in modelli animali adulti e senescenti (Kempermann, Kuhn, & Gage, 1997a, 1997b; van Praag et al., 1999).
Aspetti delle esperienze di vita, come le attività del tempo libero, potrebbero modificare i paradigmi usati dal cervello per mediare un compito, rendendoli più efficienti o resistenti di fronte alla patologia cerebrale o reclutando reti alternative. Le differenze tra individui nello stile di vita possono parzialmente mediare la relazione tra patologia cerebrale e la manifestazione clinica dell'AD, e uno stile di vita impegnato può fornire una riserva che permette a un individuo di resistere più a lungo prima che l'AD si esprima clinicamente.
Referenze
- Alexander GE, Furey ML, Grady CL, Pietrini P, Brady DR, Mentis MJ, Schapiro MB. Association of premorbid intellectual function with cerebral metabolism in Alzheimer’s disease: Implications for the cognitive reserve hypothesis. American Journal of Psychiatry. 1997;154:165–172. [PubMed]
- Arbuckle TY, Gold D, Andres D. Cognitive functioning of older people in relation to social and personality variables. Psychology and Aging. 1986;1:55–62. [PubMed]
- Arbuckle TY, Gold DP, Andres D, Schwartzman A, Chaikelson J. The role of psychosocial context, age, and intelligence in memory performance of older men. Psychology and Aging. 1992;7:25–36. [PubMed]
- Balfour JL, Masaki K, White L, Launer LJ. The effect of social engagement and productive activity on incident dementia: The Honolulu Asia Aging Study. Neurology. 2001;56(Suppl):A239.
- Bickel H, Cooper B. Incidence and relative risk of dementia in an urban elderly population: Findings of a prospective field study. Psychological Medicine. 1994;24:179–192. [PubMed]
- Broe GA, Creasey H, Jorm AF, Bennett HP, Casey B, Waite LM, Grayson DA, Cullen J. Health habits and risk of cognitive impairment and dementia in old age: A prospective study on the effects of exercise, smoking and alcohol consumption. Australian and New Zealand Journal of Public Health. 1998;22:621–623. [PubMed]
- Christensen H, Korten A, Jorm AF, Henderson AS, Scott R, Mackinnon AJ. Activity levels and cognitive functioning in an elderly community sample. Age and Ageing. 1996;25:72–80. [PubMed]
- Craik FI, Byrd M, Swanson JM. Patterns of memory loss in three elderly samples. Psychology and Aging. 1987;2:79–86. [PubMed]
- Dustman RE, Ruhling RO, Russell EM, Shearer DE, Bonekat HW, Shigeoka JW, Wood JS, Bradford DC. Aerobic exercise training and improved neuropsychological function of older individuals. Neurobiology of Aging. 1984;5:35–42. [PubMed]
- Erber JT, Szuchman LT. Memory performance in relation to age, verbal ability, and activity. Experimental Aging Research. 1996;22:59–72. [PubMed]
- Eriksson PS, Perfilieva E, Bjork-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH. Neurogenesis in the adult human hippocampus. Natural Medicines. 1998;4:1313–1317. [PubMed]
- Fabrigoule C, Letenneur L, Dartigues JF, Zarrouk M, Commenges D, Barberger-Gateau P. Social and leisure activities and risk of dementia: A prospective longitudinal study. Journal of the American Geriatrics Society. 1995;43:485–490. [PubMed]
- Friedland RP. Epidemiology, education, and the ecology of Alzheimer’s disease. Neurology. 1993;43:246–249. [PubMed]
- Friedland RP, Fritsch T, Smyth KA, Koss E, Lerner AJ, Chen CH, Petot GJ, Debanne SM. Patients with Alzheimer’s disease have reduced activities in midlife compared with healthy control-group members. Proceedings of the National Academy of Sciences of the United States of America. 2001;98:3440–3445. [PMC free article] [PubMed]
- Gold DP, Andres D, Etezadi J, Arbuckle T, Schwartzman A, Chaikelson J. Structural equation model of intellectual change and continuity and predictors of intelligence in older men. Psychology and Aging. 1995;10:294–303. [published erratum appears in Psychology and Aging 1998; 13(3): 434] [PubMed]
- Hill RD, Wahlin A, Winblad B, Backman L. The role of demographic and life style variables in utilizing cognitive support for episodic remembering among very old adults. Journal of Gerontology B Psychological Science and Social Science. 1995;50:219–227. [PubMed]
- Hultsch DF, Hammer M, Small BJ. Age differences in cognitive performance in later life: Relationships to self-reported health and activity life style. Journal of Gerontology. 1993;48:1–11. [PubMed]
- Hultsch DF, Hertzog C, Small BJ, Dixon RA. Use it or lose it: Engaged lifestyle as a buffer of cognitive decline in aging? Psychology and Aging. 14:245–263. [PubMed]
- Ince P. Pathological correlates of late-onset dementia in a multicenter community-based population in England and Wales. Lancet. 2001;357:169–175. [PubMed]
- Johansson CB, Svensson M, Wallstedt L, Janson AM, Frisen J. Neural stem cells in the adult human brain. Experimental Cell Research. 1999;253:733–736. [PubMed]
- Katzman R. Education and the prevalence of dementia and Alzheimer’s disease. Neurology. 1993;43:13–20. [PubMed]
- Katzman R, Aronson M, Fuld P, Kawas C, Brown T, Morgenstern H, Frishman W, Gidez L, Eder H, Ooi WL. Development of dementing illnesses in an 80-year-old volunteer cohort. Annals of Neurology. 1989;25:317–324. [PubMed]
- Katzman R, Terry R, DeTeresa R, Brown T, Davies P, Fuld P, Renbing X, Peck A. Clinical, pathological, and neurochemical changes in dementia: A subgroup with preserved mental status and numerous neocortical plaques. Annals of Neurology. 1988;23:138–144. [PubMed]
- Kempermann G, Kuhn HG, Gage FH. Genetic influence on neurogenesis in the dentate gyrus of adult mice. Proceedings of the National Academy of Sciences of the United States of America. 1997a;94:10409–10414. [PMC free article] [PubMed]
- Kempermann G, Kuhn HG, Gage FH. More hippocampal neurons in adult mice living in an enriched environment. Nature. 1997b;386:493–495. [PubMed]
- Kondo K, Niino M, Shido K. A case-control study of Alzheimer’s disease in Japan –significance of life-styles. Dementia. 1994;5:314–326. [PubMed]
- Kukekov VG, Laywell ED, Suslov O, Davies K, Scheffler B, Thomas LB, O’Brien TF, Kusakabe M, Steindler DA. Multi-potent stem/progenitor cells with similar properties arise from two neurogenic regions of adult human brain. Experimental Neurology. 1999;156:333–344. [PubMed]
- Laurin D, Verreault R, Lindsay J, MacPherson K, Rockwood K. Physical activity and risk of cognitive impairment and dementia in elderly persons. Archives of Neurology. 2001;58:498–504. [PubMed]
- Li G, Shen YC, Chen CH, Zhau YW, Li SR, Lu M. A three-year follow-up study of age-related dementia in an urban area of Beijing. Acta Psychiatrica Scandinavica. 1991;83:99–104. [PubMed]
- Luszcz MA, Bryan J, Kent P. Predicting episodic memory performance of very old men and women: Contributions from age, depression, activity, cognitive ability, and speed. Psychology and Aging. 1997;12:340–351. [PubMed]
- Rogers RL, Meyer JS, Mortel KF. After reaching retirement age physical activity sustains cerebral perfusion and cognition. Journal of the American Geriatrics Society. 1990;38:123–128. [PubMed]
- Salthouse T. Theoretical perspectives on cognitive aging. Hillsdale, NJ: L. Erlbaum Associates; 1991.
- Scarmeas N, Levy G, Tang M, Manly J, Stern Y. Influence of leisure activity on the incidence of Alzheimer’s disease. Neurology. 2001;57:2236–2242. [PMC free article] [PubMed]
- Scarmeas N, Zarahn E, Anderson KE, Habeck C, Hilton J, Flynn J, Marder K, Bell K, Sackeim H, Van Heertum R, Moeller JR, Stern Y. Association of life activities with cerebral blood flow in Alzheimer’s disease: Implications for the cognitive reserve hypothesis. Archives of Neurology. 2002;60:359–365. [PMC free article] [PubMed]
- Schaie K. Midlife influences upon intellectual functioning in old age. International Journal of Behavioral Development. 1984;7:463–478.
- Schaie KW. Intellectual development in adulthood: The Seattle longitudinal study. New York: Cambridge University Press; 1996.
- Schooler C, Mulatu MS. The reciprocal effects of leisure time activities and intellectual functioning in older people: A longitudinal analysis. Psychology and Aging. 2001;16:466–482. [PubMed]
- Snowdon DA, Greiner LH, Mortimer JA, Riley KP, Greiner PA, Markesbery WR. Brain infarction and the clinical expression of Alzheimer disease. The Nun Study. Journal of the American Medical Association. 1997;277:813–817. [PubMed]
- Spirduso WW. Physical fitness, aging, and psychomotor speed: A review. Journal of Gerontology. 1980;35:850–865. [PubMed]
- Stern Y. What is cognitive reserve? Theory and research application of the reserve concept. Journal of the International Neuropsychological Society. 2002;8:448–460. [PubMed]
- Stern Y, Alexander GE, Prohovnik I, Mayeux R. Inverse relationship between education and parietotemporal perfusion deficit in Alzheimer’s disease. Annals of Neurology. 1992;32:371–375. [PubMed]
- Stern Y, Alexander GE, Prohovnik I, Stricks L, Link B, Lennon MC, Mayeux R. Relationship between lifetime occupation and parietal flow: Implications for a reserve against Alzheimer’s disease pathology. Neurology. 1995;45:55–60. [PubMed]
- Stern Y, Gurland B, Tatemichi TK, Tang MX, Wilder D, Mayeux R. Influence of education and occupation on the incidence of Alzheimer’s disease. Journal of the American Medial Association. 1994;271:1004–1010. [PubMed]
- Stern Y, Tang MX, Denaro J, Mayeux R. Increased risk of mortality in Alzheimer’s disease patients with more advanced educational and occupational attainment. Annals of Neurology. 1995;37:590–595. [PubMed]
- van Boxtel MP, Langerak K, Houx PJ, Jolles J. Self-reported physical activity, subjective health, and cognitive performance in older adults. Experimental Aging Research. 1996;22:363–379. [PubMed]
- van Praag H, Kempermann G, Gage FH. Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nature Neuroscience. 1999;2:266–270. [PubMed]
- Whalley LJ, Starr JM, Athawes R, Hunter D, Pattie A, Deary IJ. Childhood mental ability and dementia. Neurology. 2000;55:1455–1459. [PubMed]
- Wilson RS, Bennett DA, Gilley DW, Beckett LA, Barnes LL, Evans DA. Premorbid reading activity and patterns of cognitive decline in alzheimer disease. Archives of Neurology. 2000;57:1718–1723. [PubMed]
- Wilson RS, Mendes de Leon CF, Barnes L, Schneider JA, Bienias JL, Evans DA, David A, Bennett DA. Participation in cognitively stimulating activities and risk of incident alzheimer disease. Journal of the American Medical Association. 2002;287:742–748. [PubMed]
- Yoshitake T, Kiyohara Y, Kato I, Ohmura T, Iwamoto H, Nakayama K, Ohmori S, Nomiyama K, Kawano H, Ueda K. Incidence and risk factors of vascular dementia and Alzheimer’s disease in a defined elderly Japanese population: The Hisayama Study. Neurology. 1995;45:1161–1168. [PubMed]
- Zabar Y, Corrada M, Fozard J, Costa P, Kawas C. Does frequent participation in cognitively demanding leisure activities reduce the risk of developing dementia? Neurology. 1996;46(Suppl):A435.
Fonte: Nikolaos Scarmeas e Yaakov Stern in US National Library of Medicine (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.

 Associazione Alzheimer OdV
Associazione Alzheimer OdV